
|
|
|
|
Oxidationszahlen |
| Die Oxidationszahl gibt an, wieviele Elektronen ein neutrales Atom innerhalb einer Verbindung aufgenommen oder abgegeben hat. |
In der chemischen Formel wird die Oxidationszahl über dem zugehörigen Element als arabische Zahlen geschrieben. Das Vorzeichen steht vor der Zahl, im Gegensatz zu dem der Ladungszahl.
Hier nun einige Beispiele:
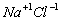 |
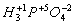 |
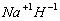 |
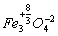 |
Früher war es üblich römische Zahlen zu benutzen. Heutzutage bevorzugt man die arabischen Zahlen, weil man auch die 0 und gebochene Zahlen zur Verfügung hat.
Oxidationszahlen (OZ) dienen zur systematischen Klassifizierung von Verbindungen, zur Interpretation bestimmter Eigenschaften von Verbindungen (z.B. magnetische Eigenschaften) und sind nützlich beim Formulieren von Redoxvorgängen.
Beispiele:
| H20 | S80 | O20 | Na0 |
Beispiele:
| Verbindung | formale Ionen | Oxidationszahlen |
| CaO | Ca2+ O2- | Ca+2 O-2 |
| Fe3O4 | 2 Fe3+ Fe2+ 4 O2- | Fe3+8/3 O42- |
Die Summe der OZ aller Atome einer mehratomigen Verbindung ist gleich Null. Die Summe der OZ aller Atome eines mehratomigen Ions ist gleich der Gesamtladung dieses Ions.
Bei kovalenten Verbindungen teilt man die Verbindung formal in Ionen auf. Dabei wird angenommen, dass die Bindungselektronen vollständig vom elektronegativeren Bindungspartner übernommen werden. Die OZ entspricht dann der erhaltenen Ionenladung.
Beispiele:
| Verbindung | Lewisformel | fiktive Ionen | Oxidationszahlen |
| CaO | |||
| H2O2 | |||
| SF6 |
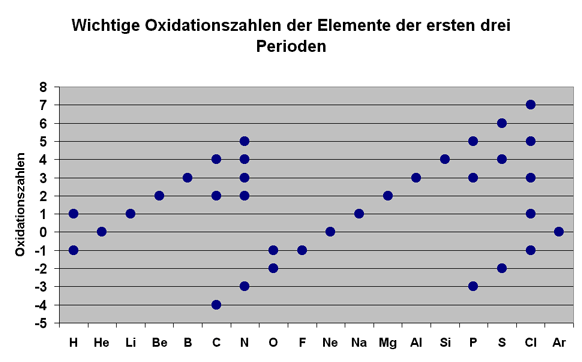
Die positive OZ eines Elements kann nicht grösser sein als die Gruppennummer dieses Elements. Ausnahme:1. Nebengruppe
Die maximale negative OZ ist nach der alten Gruppeneinteilung Gruppennnummer - 8 und nach der neuen Gruppeneinteilung Gruppennummer - 18.
Beispiele:
Chalkogene: -2 und Halogene: -1
Als elektronegativstes Element kann Fluor keine positiven OZ annehmen.
Die meisten Elemente treten in mehreren OZ auf
| Weiter |
| |
| Zurück |
| © 2000–2014 Pietro Naro, [email protected] | ChemGlobe |