

|
Empirische Formeln |
| ⬇ |
Eine empirische Formel gibt das einfachste Zahlenverhältnis an, in dem die Elemente in einer
Verbindung vorkommen. Die empirische Formel für Wasserstoffperoxid ist HO. Diese Formel lässt sich
durch Verbrennungsanalyse bestimmen. Es handelt sich dabei um eine einfache Methode, bei der
eine bekannte Menge der zu analysierenden Probe in Gegenwart von rotglühendem Kupferoxid
verbrannt wird. Das Kupferoxid wird dabei zu metallischem Kupfer reduziert. Anschliessend wird die
Probe mit einem Strom von reinem Sauerstoff aus dem Verbrennungsrohr getrieben, wobei das Kupfer
wieder zu Kupferoxid oxidiert wird.
Die Verbrennungsprodukte werden durch ein Rohr mit Calciumchlorid geleitet, welches das gebildete
Wasser absorbiert, und anschliessend durch ein Rohr mit wässrigem Kaliumhydroxid, das das gebildete
Kohlendioxid absorbiert. Die beiden Röhrchen werden vor und nach der Verbrennung gewogen, um die
Menge des Wassers und des Kohlenstoffdioxids zu bestimmen. Aus den Massen dieser beiden Produkte und
der Masse der verbrannten Probe ist es möglich , eine empirische Formel für die verbrannte
Substanz aufzustellen.
Um aus dieser Verhältnisformel auf die Molekularformel zu kommen, bedarf es einer
Molekulargewichtsanalyse (z.B. durch Massenspektroskopie).
Diese Verbrennungsanalyse wurde von Lavoisier und Liebig entwickelt und gab der Organischen Chemie einen gewaltigen Auftrieb, erforderte aber relativ grosse Substanzmengen in der Grössenordnung von 0.25 bis 0.50 g. 1911 führte Fritz Pregl die Mikroanalyse ein, die Verbrennungsanalysen mit nur 3-4 mg Substanz erlaubte.
Als praktisches Beispiel wollen wir hier die Verbrennung von 15mg Cumarin (enthält laut qualitativer Analyse C,H und O) betrachten. Sie liefert 40.65 mg Kohlendioxid und 5.55 mg Wasser.
Als ersten Schritt müssen wir den Massenanteil von C im CO2 und von H im H2O berechnen, um damit auf die effektive Masse von C im CO2 und von H im H2O zu schliessen:
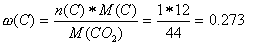
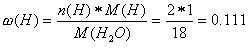
Aus diesen Anteilen und der Menge an Kohlendioxid und Wasser kann man die Menge an Kohlenstoff und Wasserstoff im CO2 und im H2O ermitteln:
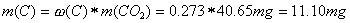
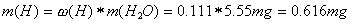
Aus diesen Werten lassen sich nun die prozentualen Anteile der Elemente C,H und O berechnen, indem wir durch die Menge an eingesetzter Probe dividieren und mit 100 multiplizieren:
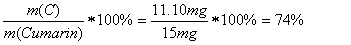
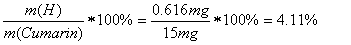
Daraus kann leicht den prozentualen Massenanteil von Sauerstoff im Cumarin ermitteln:
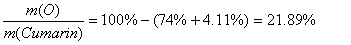
Dies wiederum heisst, dass in 100g Cumarin 74g C, 4.11g H und 21.89g O enthalten sind. Anhand der Molmasse lässt sich die Stoffmenge berechnen:
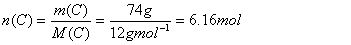
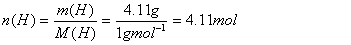
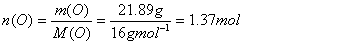
Division durch den kleinsten Wert ergibt 1.00 für O, 3.00 für H und 4.50 für C. Multiplikation mit 2 ergibt ganze Zahlen und somit die empirische Formel für Cumarin:

| ⬆ |
| ⬆ |
| © 1998–2022 ChemGlobe |