
|
|
|
|
Elektronegativität |
| Die Elektronegativität ist ein Mass für die Fähigkeit eines Atoms in einer
Bindung das bindende Elektronenpaar an sich zu ziehen. | Aufgepasst: nur das bindende Elektronenpaar, nicht generell! |
Im folgenden wird Elektronegativität mit 'EN' abgekürzt.
Die positiven Ladungen des Atomkerns werden nach aussen hin von den umgebenden Elektronen abgeschirmt. Ein Atom im Grundzustand besitzt keine messbare Ladung. Stellen wir uns nun vor, wir würden auf der äusseren Elektronenschale herumfliegen. Wenn wir dann die Anzahl ganzer positiver Ladungen messen, die uns erreichen, dann ist das jeweils die Anzahl
Protonen - Elektronen in den Schalen unter einem selbst
Die auf diese Art 'übrigbleibende' Ladung auf der letzten Schale, steht
in Zusammenhang mit der Elektronegativität.
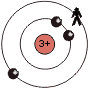
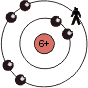
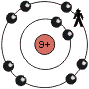
Die Tendenz innerhalb einer Periode wirkt sich folgendermassen aus (Beispiel: Periode 2):
| Atom | Li | C | F |
|---|---|---|---|
| Situtation im Grundzustand |
 |
 |
 |
| Gruppe (neue IUPAC-Empfehlung) | 1 | 14 | 17 |
| 'übrigbleibende' Ladung |
1+ | 4+ | 7+ |
Die Zunahme der 'übrigbleibende' Ladung auf der letzten Schale innerhalb einer Periode bewirkt, dass die Atome in einer Periode, mit steigender Ordnungszahl, eine steigende EN haben.
Die Tendenz innerhalb einer Gruppe wirkt sich folgendermassen aus (hier Gruppe 1):
| Atom | Situtation im Grundzustand | Periode | 'übrigbleibende' Ladung |
|---|---|---|---|
| Li |  |
2 | 1+ |
| Na | 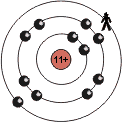 |
3 | 1+ |
| K | 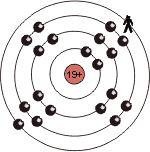 |
4 | 1+ |
Innerhalb einer Gruppe, bleibt bei steigender Ordnungszahl, die 'übrigbleibende', positive Ladung auf der letzten Schale zwar unverändert, dafür steigt aber die Distanz zum Atomkern, und somit zu den positiven Ladungen. Demnach wird die 'übrigbleibende' Ladung auf der letzten Schale kleiner, desto weiter man sich vom Atomkern entfernt, also desto höher die Ordnungszahl ist.
Aus diesen beiden Tatsachen kann man schliessen, dass Fluor (rechts oben in der Periodentafel) das Element mit der höchsten EN ist, und Francium (links unten in der Periodentafel) das Element mit der tiefsten EN ist.
| Helium und alle anderen Edelgase besitzen keine EN, da die EN nur für Bindungselektronen definiert ist, und die Edelgase keine chemischen Bindungen eingehen!! |
Dies ist, um es noch einmal zu wiederholen, eine rein qualitative Betrachtung!
Um die EN in eine fest definierte Skala zu bringen haben verschiedene Wissenschaftler, verschiedene Bestimmungsvorschriften gegeben. Die wichtigsten Skalen sind die von Pauling und die von Allred & Rochow.
Pauling hat die erste Skala für EN aus Bindungsenergien hergeleitet. Er hat folgendes gesagt:
Die Dissoziationsenergie, die benötigt ist, um die Atome A und B in dem Molekül AB mit einer polaren Atombindung voneinander zu trennen, ist grösser als die Summe der Mittelwerte der Dissoziationsenergien der Moleküle A2 und B2.
![]() hängt von
der Polarität der Bindung ab. Desto polarer die Bindung, desto grösser
hängt von
der Polarität der Bindung ab. Desto polarer die Bindung, desto grösser
![]() .
Pauling postulierte, dass
.
Pauling postulierte, dass ![]() dem Quadrat der EN-Differenz proportional sei. Da Dissoziationsenergien in der Chemie
in kJ/mol ausgedrückt werden, in der Physik aber Atomeigenschaften lieber eV benutzt
werden, tritt in der folgenden Formel der Wert 96 als Konvertierungsfaktor auf.
dem Quadrat der EN-Differenz proportional sei. Da Dissoziationsenergien in der Chemie
in kJ/mol ausgedrückt werden, in der Physik aber Atomeigenschaften lieber eV benutzt
werden, tritt in der folgenden Formel der Wert 96 als Konvertierungsfaktor auf.
Da ![]() gemessen
werden kann, können die x-Werte (also die EN-Werte) abgeleitet werden. Dazu braucht es nur
einen ersten x-Wert, also eine definierte EN für ein Element. Pauling definierte
die EN für Fluor als 4.0.
gemessen
werden kann, können die x-Werte (also die EN-Werte) abgeleitet werden. Dazu braucht es nur
einen ersten x-Wert, also eine definierte EN für ein Element. Pauling definierte
die EN für Fluor als 4.0.
Die Skala von Allred & Rochow wird auch allgemein benutzt. Die Herleitung, die sie benutzt
haben, passt exakt zu der qualitativen Betrachtung![]() ,
die oben auf dieser Seite geführt wird.
Sie sagten, dass die EN proportional zu F ist, wobei F die elektrostatische
Anziehungskraft ist, die von der Kernladung Z auf die Bindungselektronen ausgeübt wird.
Die Kraft F wird aber zusätzlich von den inneren Elektronen abgeschirmt (Ze),
und nimmt mit der Distanz ab (Zeff).
Diese beiden Effekte werden, für die effektiv wirkende Kraft, so übernommen:
,
die oben auf dieser Seite geführt wird.
Sie sagten, dass die EN proportional zu F ist, wobei F die elektrostatische
Anziehungskraft ist, die von der Kernladung Z auf die Bindungselektronen ausgeübt wird.
Die Kraft F wird aber zusätzlich von den inneren Elektronen abgeschirmt (Ze),
und nimmt mit der Distanz ab (Zeff).
Diese beiden Effekte werden, für die effektiv wirkende Kraft, so übernommen:
Die bestmögliche Anpassung an die Skala von Pauling erhält man mit der folgenden Beziehung:
Mulliken fand, dass die EN eines Atoms der Differenz seiner Ionisierungsenergie und seiner Elektronenaffinität proportional ist. Im Klartext: die Tendenz eines gebundenen Atoms, die Bindungselektronen an sich zu ziehen, ist grösser, je grösser die Fähigkeit dieses Atoms ist, sein eigenes Elektron festzuhalten und zusätzlich ein neues aufzunehmen.
Das Problem, und gleichzeitig der Vorteil, ist es, dass diese EN sich nicht auf den Grundzustand des jeweiligen Atoms bezieht, sondern auf den jeweiligen Valenzzustand, in dem es sich gerade befindet. Wenn man also die Elektronegativität von Kohlenstoff wissen will, muss man die Ionisierungsenergie und die Elektronenaffinität des 'bindenden Hybrid-Orbitals' kennen. Man nennt die Mulliken-Elektronegativitätem deshalb auch noch Orbital-Elektronegativitäten.
Beispiel:CH3-Cl: Im Chlormethan gibt es einen Dipolmoment mit negativem Ladungsschwerpunkt
am Chlor.
Cl-C![]() C-H:
Im Chlorethin gibt es einen Dipolmoment mit negativem Ladungsschwerpunkt
am Kohlenstoff.
C-H:
Im Chlorethin gibt es einen Dipolmoment mit negativem Ladungsschwerpunkt
am Kohlenstoff.
Die Erklärung dafür liegt in der Tatsache, dass verschiedene Orbitale, verschiedene
Elektronegativitäten besitzen. Die EN der ![]() -Orbitale
ist generall grösser als die der
-Orbitale
ist generall grösser als die der ![]() -Orbitale.
In einer Mehrfachbindung können die verschiedenen Bindungen (
-Orbitale.
In einer Mehrfachbindung können die verschiedenen Bindungen (![]() und
und ![]() )
sich also 'bekämpfen'.
)
sich also 'bekämpfen'.
Die Mulliken-Skala kann mit folgender Formel gut an die Pauling-Skala angepasst werden:
wobei I und Eea in eV einzusetzen sind.
Nach der Theorie von Mulliken kann man eine Skala mit absoluten EN'en erhalten:
Es müssen hier die Ionisierungsenergien und Elektronenaffinitäten der Atome im Grundzustand genommen werden.
| Elektronegativität der Hauptgruppen im PSE | |
|---|---|
| Nach Pauling | Nach Allred & Rochow |
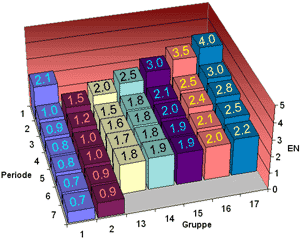 |
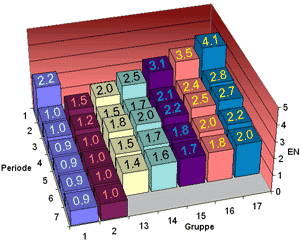 |
| Periodizität der EN (Allred & Rochow) |
|---|
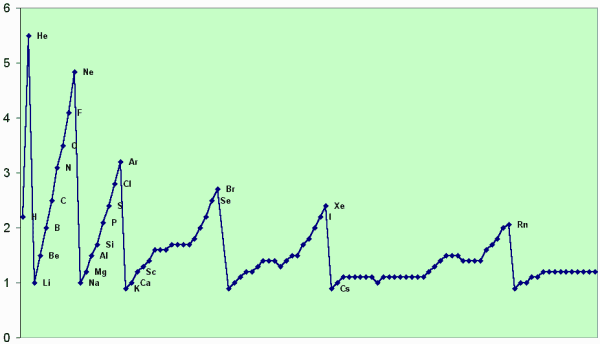 |
Innerhalb von ChemGlobe
Im WWW
Literatur
| Weiter |
| |
| Zurück |
| © 1999–2014 Paul Kremer, [email protected] | ChemGlobe |